![]() Este documento sólo
podrá ser reproducido en su integridad y sin cambios. Antes de realizar el procedimiento
que se describe a continuación, aconsejamos que lo lea varias veces.
Este documento sólo
podrá ser reproducido en su integridad y sin cambios. Antes de realizar el procedimiento
que se describe a continuación, aconsejamos que lo lea varias veces.
Este método es experimental. El objetivo de divulgar la siguiente información es promover la investigación científica sobre la naturaleza de estos elementos.
El proceso que se describe a continuación no ha sido probado de manera extensa. No se ofrece ninguna garantía sobre el procedimiento descrito en este documento ni sobre los resultados que se puedan obtener con él. Sin importar la manera en que usted realice este procedimiento o utilice los productos obtenidos con él, lo hace siempre por su cuenta y riesgo. En ningún caso los autores de este documento ni su traductor se hacen responsables ante usted ni ante cualquier otra persona, organización o gobierno de cualquier daño que se produzca al realizar este procedimiento o utilizar el producto resultante.
No recomendamos la ingestión de estos elementos debido a que se conoce muy poco sobre ellos. La siguiente información se facilita para promover la investigación científica sobre su naturaleza. Puesto que somos conscientes de que, a pesar de nuestra recomendación, algunas personas ingerirán estos elementos, ofrecemos la información contenida en los apartados PRECAUCIONES y ADVERTENCIAS para minimizar cualquier efecto adverso que pueda producirse como resultado de su ingestión.
En este método se utiliza una técnica de laboratorio llamada medición del pH. El pH es una medida de la acidez o alcalinidad de una solución química. Un líquido con un pH menor de 7 es ácido, como el vinagre blanco destilado (ácido acético); un líquido con un pH de 7 es neutro, como el agua destilada; y un líquido con un pH mayor de 7 es alcalino, como la sosa cáustica.
El ORMUS se precipita a un Ph de entre 8.5 y 10.78.
En resumen, el método húmedo consiste en lo siguiente:
1. Se filtra el agua de mar para limpiarla.
2. Lentamente se añade una solución de sosa cáustica mezclada con agua para subir el pH por encima de 8.5, pero por debajo de 10.78.
3. Se formará un precipitado blanco esponjoso que deberá dejarse reposar durante toda una noche.
4. Se retira el líquido que permanece sobre el precipitado.
5. Se limpia cuidadosamente el precipitado. Este estará compuesto de hidróxido de calcio, leche de magnesia Mg(OH)2 y una pequeña cantidad de elementos en estado m.
6. Se esteriliza la solución hirviéndola durante cinco minutos.
Nota: Es aconsejable hervir los recipientes, jeringuillas, etc., antes de utilizarlos para esterilizarlos.
La sosa cáustica puede dañar los ojos volviendo la córnea opaca, lo cual es incurable. También puede causar quemaduras en la piel, en la ropa y en los ojos. Trabaje cerca de un grifo, boca de riego o cualquier otra fuente de agua. También puede tener a mano una botella con spray de vinagre blanco destilado para utilizar en caso de salpicaduras.
Si la sosa cáustica salpica la ropa o la piel, lave inmediatamente la zona afectada con abundante agua. Cuando trabaje con sosa cáustica, evite tocarse la cara o los ojos. No manipule la sosa cáustica cerca de ningún alimento, y hágalo en un lugar bien ventilado. No arroje el agua residual en la tierra. La sosa cáustica se puede verter en un desagüe, pero asegúrese de no mezclarlo con ningún ácido, como el salfumant, puesto que podría provocar una reacción explosiva.
Cuando trabaje con sosa cáustica, deberá llevar gafas protectoras o un visor industrial de los que cubren toda la cara, y también guantes y un delantal de laboratorio.
Mantenga a los animales domésticos y a los niños fuera del área de trabajo, y no deje los utensilios desatendidos cuando alguno de ellos esté cerca.
A continuación se enumeran los materiales que producen más precipitado.
En todos los casos se deberá filtrar el agua para eliminar el polvo y otras impurezas.
Por favor, lea los apartados PRECAUCIONES y ADVERTENCIAS antes de realizar el siguiente procedimiento.
En primer lugar deberá preparar una solución de sosa cáustica diluida con agua. Coloque una etiqueta en una botella con cuentagotas que ponga: «Sosa cáustica – veneno» para que no se pueda confundir su contenido. Trabaje en un fregadero para que la solución no salpique fuera. Puesto que al mezclar sosa cáustica con agua se producen gases irritantes, deberá colocarse una careta para no inhalarlos y gafas protectoras. Colóquese también guantes y un delantal de laboratorio. Asegúrese de que el lugar en el que vaya a trabajar tenga buena ventilación.
Dentro de un fregadero, vierta medio vaso de agua destilada en un recipiente de cristal grueso y luego añada una cucharada sopera rasa de sosa cáustica en polvo mientras agita la solución. Siga agitándola hasta que la sosa cáustica se disuelva por completo. Se producirá calor a medida que la sosa cáustica se disuelva y el recipiente se calentará.
Se pueden utilizar otras cantidades en una proporción de una unidad de sosa cáustica en polvo por cada ocho o diez unidades de agua destilada.
Vierta la solución de sosa cáustica en la botella con cuentagotas en la que ha colocado la etiqueta.
Si va a utilizar papel de tornasol, corte varios trozos de unos 6 mm y colóquelos sobre una hoja o servilleta de papel blanco en un plato. Para mayor precisión, puede recalibrar el papel de tornasol con búferes de pH 4, 7 y 10.
Si va a utilizar sal como materia prima, mezcle media taza de sal con un litro de agua destilada y agítela. Se pueden utilizar otras cantidades en una proporción de una unidad de sal por cada seis u ocho unidades de agua destilada. Esto producirá agua de mar, y luego proceda como sigue:
1. Filtre el agua de mar con un filtro de café sin blanquear y un colador de plástico.
2. Coloque el agua de mar en un recipiente de acero inoxidable. Lentamente, gota a gota, añada la solución de sosa cáustica al agua de mar MIENTRAS LA AGITA. Deberá ir añadiendo las gotas en la parte externa del recipiente, no en el centro. Cada diez gotas, compruebe el pH tomando varias muestras de diferentes partes del líquido con un cuentagotas. Si utiliza papel de tornasol, deberá subir el pH hasta 9.5 y luego parar. Si utiliza un medidor, pare justo antes de que el pH llegue a 10.78. Se formará un precipitado que contendrá elementos en estado m.
PRECAUCIONES: Deberá proceder lentamente y con paciencia para no superar el límite de pH de 9.5 si utiliza papel de tornasol o de 10.78 si utiliza un medidor. Si el pH supera el límite de 10.78, podrían aparecer metales pesados en el precipitado. Aunque hay personas que afirman que con sales del Mar Muerto no aparecen estos metales pesados, no se tienen pruebas concluyentes de ello.
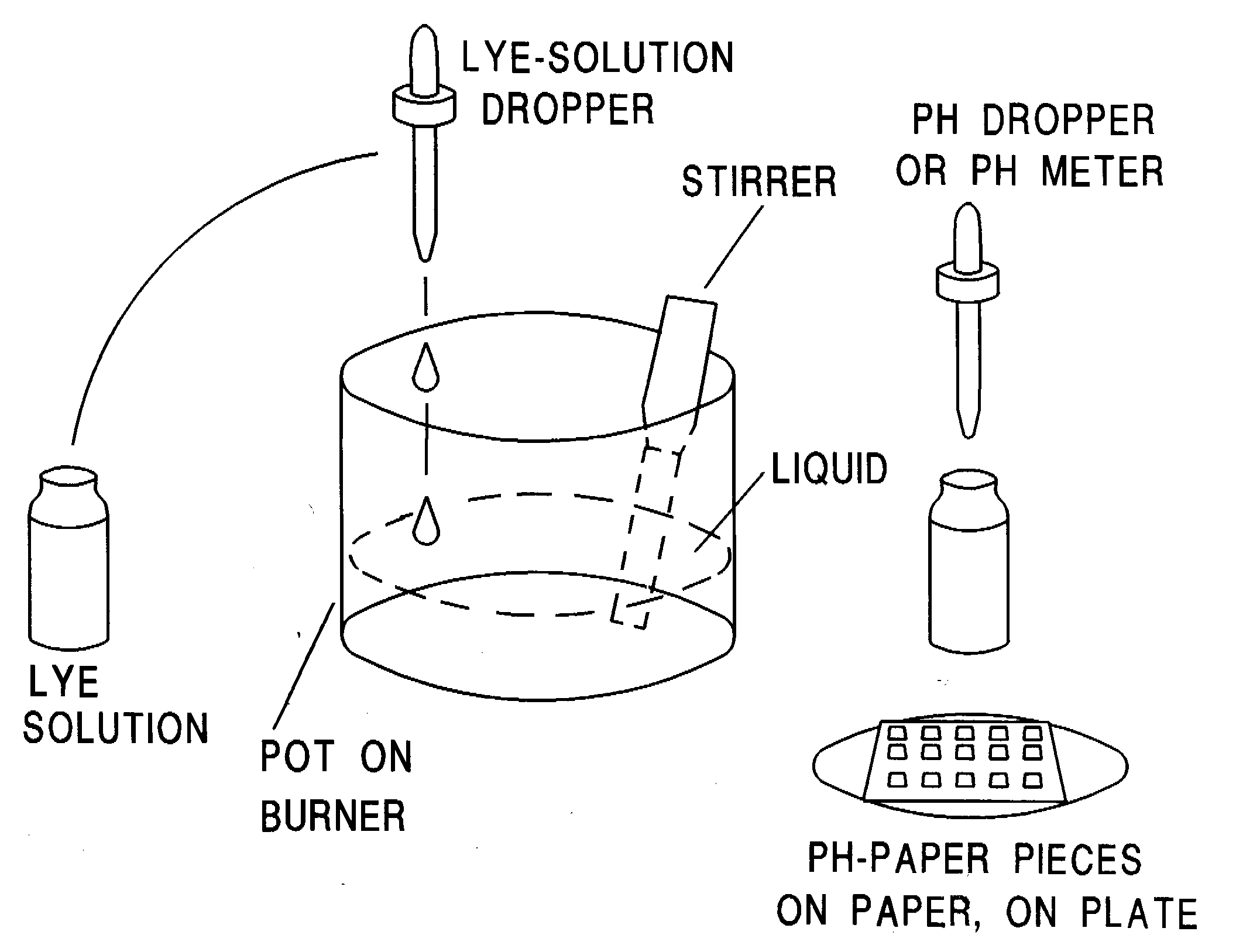
3. En cuanto llegue al pH correcto, deje de añadir solución de sosa cáustica.4. Vierta la solución en un recipiente de cristal limpio o en un tubo de ensayo.
5. El precipitado blanco se depositará lentamente en el fondo del recipiente. Déjelo reposar durante toda una noche. El precipitado estará compuesto por hidróxido de calcio, leche de magnesia Mg(OH)2, una pequeña cantidad de elementos en estado m, sosa cáustica y algunas impurezas.
6. Utilizando una jeringuilla grande o un sifón, extraiga el líquido que permanece sobre el precipitado.
7. Añada más agua destilada al precipitado hasta llenar el recipiente, agite bien el líquido y déjelo reposar de nuevo 4 o 5 horas, preferiblemente durante toda una noche.
8. Repita los pasos sexto y séptimo al menos tres veces para limpiar el precipitado. De este modo eliminará casi toda la sosa cáustica. En este momento, el precipitado estará compuesto por hidróxido de calcio, leche de magnesia Mg(OH)2, una pequeña cantidad de elementos en estado m y quizá algunas impurezas.
9. Vierta el precipitado con agua en un recipiente de acero inoxidable y caliéntelo en una cocina a gas. No lo haga en una cocina eléctrica, puesto que los campos magnéticos podrían eliminar los elementos en estado m. Cubra el recipiente con una tapadera para que los elementos en estado m no se escapen y hierva la solución durante cinco minutos para esterilizarla. Tenga cuidado de que no se salga la solución caliente. Déjela enfriar por completo y compruebe que el pH no sea superior a 9.
También se puede hervir el agua de mar antes de añadir la solución de sosa cáustica. De este modo, la reacción y el precipitado se producirán con mayor rapidez, pero aumentará el riesgo de salpicaduras e inhalación de gases.
Puesto que este producto es laxante, a continuación se ofrece un método opcional para eliminar la leche de magnesia Mg(OH)2.
Cómo purificar el precipitado
Con el siguiente procedimiento se elimina la leche de magnesia Mg(OH)2 bajando el pH del precipitato por debajo de 9. Para ello, necesitará salfumant (ácido clorhídrico HCl), aunque es preferible utilizar vinagre blanco destilado (ácido acético), y un filtro de café sin blanquear.
1. Seque el precipitado en una estufa de secado a unos 135º centígrados durante una o dos horas para convertirlo en un polvo seco.
2. Pulverice cualquier aglomerado que contenga el polvo seco.
3. Coloque el polvo seco en un recipiente de cristal y añada agua destilada en una proporción de uno a cuatro.
4. Añada salfumant (ácido clorhídrico HCl) o vinagre blanco destilado (ácido acético) gota a gota hasta que el pH baje a 5 o 6.
5. Vierta la solución en una botella, agítela y déjela reposar durante toda una noche. La leche de magnesia Mg(OH)2 se disolverá a este pH, pero no los elementos en estado m.
6. Al día siguiente, después de que la leche de magnesia Mg(OH)2 se haya disuelto, vierta el líquido en un filtro de café sin blanquear.
7. Recoja el polvo que queda en el filtro de café sin blanquear y lávelo varias veces con agua destilada para eliminar cualquier residuo de salfumant (ácido clorhídrico HCl) o vinagre blanco destilado (ácido acético).
8. El polvo limpio debe secarse de nuevo en una estufa de secado a unos 135º centígrados, y el polvo seco resultante contendrá elementos en estado m libres de leche de magnesia Mg(OH)2.